
สถานะของสาร คือการจำแนกสารโดยพิจารณารูปร่างและปริมาตรของสาร สามารถแบ่งสารออกเป็น 3 สถานะ ได้แก่ ของแข็ง ของเหลว และแก๊ส สามารถแบ่งสารออกเป็น 3 สถานะ ได้แก่ ของแข็ง ของเหลว และแก๊ส

คุณสมบัติที่สำคัญของ ของแข็ง
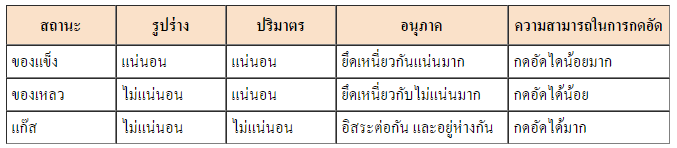
1. มีปริมาตรและรูปร่างที่แน่นอน
2. อนุภาคยึดกันอย่างหนาแน่น
3. อนุภาคเรียงตัวกันเป็นระเบียบ
4. แรงยึดเหนี่ยวระหว่างอนุภาคมาก
5. จุดเดือดสูง จุดหลอมเหลวสูง 
ลักษณะที่สำคัญของ ของแข็ง
1. เป็นผลึกสามมิติ มีเหลี่ยม มุมแตกต่างกันตามชนิดของสาร เช่น เกลือ นํ้าตาล สารส้ม ควอตซ์
2. เป็นของแข็งอสัณฐาน (มีโครงสร้างไม่แน่นอน) เช่น พลาสติก เจล

1. อนุภาค  ยึดเหนี่ยวกันหนาแน่นน้อยกว่าของแข็ง ยึดเหนี่ยวกันหนาแน่นน้อยกว่าของแข็ง
2. รูปร่างเปลี่ยนตามภาชนะที่บรรจุ
3. ปริมาตรเท่าเดิม เมื่อเปลี่ยนอุณหภูมิและความดัน
4. สามารถเคลื่อนที่ได้อย่างเสรี

1. ปริมาตรขึ้นอยู่กับความดันและภาชนะที่บรรจุ
2. อนุภาคอยู่กระจัดกระจาย
3. อนุภาคเคลื่อนที่ได้อิสระ
4. ปริมาตรและรูปร่างไม่แน่นอน
ตารางเปรียบเทียบสถานะของสาร ทั้ง 3 สถานะ





สารสามารถเปลี่ยนสถานะจากสถานะหนึ่งเป็นอีกสถานะหนึ่ง โดยมีพลังงาน เข้ามาเกี่ยวข้อง เข้ามาเกี่ยวข้อง


ความร้อนที่เกี่ยวข้องกับการเปลี่ยนสถานะ มีอยู่ 2 ช่วง
1. ความร้อนที่เปลี่ยนสถานะจากของแข็งเป็นของเหลว เรียกว่า “ความร้อนแฝงของการหลอมเหลว”
2. ความร้อนที่เปลี่ยนสถานะจากของเหลวเป็นแก๊ส เรียกว่า “ความร้อนแฝงของการกลายเป็นไอ”







ความร้อนแฝง คือ พลังงานความร้อนที่ใช้ในการทำให้สารเปลี่ยนสถานะเป็นอีกสถานะหนึ่ง โดยที่อุณหภูมิของสารขณะเกิดการเปลี่ยนแปลงมีค่าคงที่ คือ พลังงานความร้อนที่ใช้ในการทำให้สารเปลี่ยนสถานะเป็นอีกสถานะหนึ่ง โดยที่อุณหภูมิของสารขณะเกิดการเปลี่ยนแปลงมีค่าคงที่

พลังงานความร้อนมีหน่วยเป็น แคลอรี่ หรือ จูล โดยกำหนดให้ 1 แคลอรี่ หมายถึง ปริมาณความร้อน ที่ทำให้นํ้ามวล 1 กรัม มีอุณหภูมิเพิ่มขึ้น 1 °C และ 1 แคลอรี (Cal) มีค่าประมาณ 4.2 จูล (J)

1. ความร้อนแฝงจำเพาะ  ของการหลอมเหลวของนํ้า = 80 Cal ของการหลอมเหลวของนํ้า = 80 Cal
2. ความร้อนแฝงจำเพาะของการกลายเป็นไอของนํ้า = 540 Cal













|


