|

1. เพื่อให้นักเรียนสามารถเตรียมผลึกจากสารละลายอิ่มตัว ที่อุณหภูมิสูง ที่อุณหภูมิสูง
2. เพื่อให้นักเรียนสามารถอธิบายการใช้ประโยชน์จากการเกิดผลึกของสารละลายอิ่มตัว
3. เพื่อให้นักเรียนสามารถยกตัวอย่างกระบวนการเกิดผลึกในธรรมชาติ

1. คอปเปอร์ (II) ซัลเฟต 38 g

|
2. โซเดียมคลอไรด์ 20 g

|
3. สารส้ม 15 g

|
4. โพแทสเซียมไนเตรต 130 g

|
5. นิกเกิลซัลเฟต 39 g

|
6. โคบอลต์ซัลเฟต 42 g

|
7. นํ้ากลั่น 200 cm3

|
8. ด้ายเส้นเล็ก ยาว 10" 1 เส้น

|
9. บีกเกอร์ขนาด 100 cm3 2 ใบ

|
10. แท่งแก้วคนสาร 1 อัน

|
11. ชุดตะเกียงแอลกอฮอล์พร้อมที่กั้นลม 1 ชุด

|
|

1. วางแผนออกแบบวิธีเตรียมผลึกของสารที่สนใจ เช่น เกลือแกง สารส้ม จุนสี รวบรวมข้อมูลเกี่ยวกับความสามารถในการละลายของสารนั้นที่อุณหภูมิต่างๆ
2. เตรียมสารละลายอิ่มตัวที่มีอุณหภูมิประมาณ 40-50 °C ตั้งไว้ในที่ที่ไม่ถูกรบกวน สังเกตการเปลี่ยนแปลง
3. เลือกผลึกก้อนเล็กๆ ที่เกิดขึ้นในภาชนะ ผูกก้อนผลึกด้วยด้านเส้นเล็กๆ แขวนผลึกไว้ในสารละลายอิ่มตัวนั้น สังเกตการณ์เปลี่ยนแปลงต่อไปและบันทึกผล

ผลการทดลอง ที่ได้คือ
สารตัวอย่าง |
สภาพการละลายได้ของสาร
เป็นกรัมในนํ้า 100 กรัม
สารตัวอย่าง ณ อุณหภูมิ |
ลักษณะผลึกที่ได้เป็น
รูปร่างทรงเรขาคณิต
(วาดรูป) |
100 °C |
0 °C |
จุนสี (คอปเปอร์ (II) ซัลเฟตเพนตะไฮเดรต: CuSO4.5H2O) |
76.0 |
14.0 |
รูปโมโนคลินิก สีนํ้าเงิน
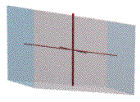 |
เกลือแกง (โซเดียมคลอไรด์: NaCl) |
39.8 |
35.7 |
รูปสี่เหลี่ยมลูกบาศก์
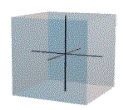 |
สารส้ม (โพแทสเซียม อะลูมิเนียมซัล
เฟต โดเดดะไฮเดรท) : โพแทสอาลัม
KAl(SO4)2.12H2O |
27.0
(ที่อุณหภูมิ
57 °C) |
2.1 |
รูปปิรามิดฐานสี่เหลี่ยม
2 รูป ประกบกัน
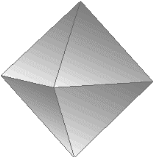 |
นิกเกิลซัลเฟตเฮปตะไฮเดรต
(NiSO47H2O) |
77.0 |
27.0 |
Orthorhombic สีเขียว
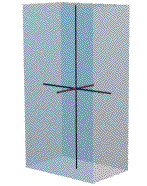 |
สรุปได้ว่า
1. สารละลายอิ่มตัว คือสารละลายที่ตัวละลายสามารถละลายอยู่ได้มากที่สุด ณ อุณหภูมินั้น
2. การตกผลึก
 เป็นกระบวนการที่สารบริสุทธิ์แยกตัวออกจากสารละลายอิ่มตัวในรูปของของแข็ง ผลึกที่เกิดขึ้นเป็นสารบริสุทธิ์ ประกอบด้วยสารเพียงชนิดเดียว มีรูปทรงเรขาคณิต มีเหลี่ยม มีมุม ผิวหน้าเรียบ ถ้ามีตัวละลายหลายชนิด สารที่มีสภาพการละลายได้น้อย จะตกผลึกแยกออกมาก่อน เป็นกระบวนการที่สารบริสุทธิ์แยกตัวออกจากสารละลายอิ่มตัวในรูปของของแข็ง ผลึกที่เกิดขึ้นเป็นสารบริสุทธิ์ ประกอบด้วยสารเพียงชนิดเดียว มีรูปทรงเรขาคณิต มีเหลี่ยม มีมุม ผิวหน้าเรียบ ถ้ามีตัวละลายหลายชนิด สารที่มีสภาพการละลายได้น้อย จะตกผลึกแยกออกมาก่อน


 
|

